
經(jīng)濟觀察網(wǎng) 記者 張斌 2月9日,百奧泰(688177.SH)股價逆市大跌18.73%,創(chuàng)上市以來最大單日跌幅。截至收盤,報收25.03元/股,較32.76元/股的發(fā)行價下跌23.6%。
消息面上,百奧泰2月8日晚發(fā)布公告,宣布終止ADC藥物BAT8001(即注射用重組人源化抗HER2單克隆抗體-美登素偶聯(lián)物)對HER2陽性乳腺癌的臨床試驗。截至2020年末,該項目研發(fā)投入累計2.26億元。
乳腺癌常被稱為“粉紅殺手”,其發(fā)病率位居女性惡性腫瘤的首位,也是中國女性常見的癌癥。目前乳腺癌的藥物研發(fā)以抗體類藥物為主,其中HER2是抗體研發(fā)的主要靶點。隨著BAT8001對HER2陽性乳腺癌的臨床試驗宣布終止,誰將扛起國產(chǎn)抗擊“粉紅殺手”的大旗?
為何終止?
百奧泰2月8日晚連發(fā)兩份公告,第一份公告為HER2 ADC藥物BAT8001III期臨床主要療效指標無進展生存期(PFS)相比對照組(拉帕替尼聯(lián)合卡培他濱)未達到預設的優(yōu)效目標。基于目前的初步分析結果,百奧泰計劃未來與國家藥品監(jiān)督管理局(NMPA)做進一步溝通。
但在當晚隨后的發(fā)布的第二份公告中,百奧泰則宣布終止BAT8001針對 HER2陽性乳腺癌的臨床試驗。
對于終止的的原因,百奧泰的解釋為:“該藥物將難以在與眾多靶向抗腫瘤藥物的競爭中獲得優(yōu)勢,為合理配置公司研發(fā)資源,聚焦研發(fā)管線中的優(yōu)勢項目,經(jīng)公司審慎考量 BAT8001的后續(xù)開發(fā)風險,決定終止該項目的臨床試驗。”
公告顯示,BAT8001針對HER2 陽性乳腺癌的 III 期臨床研究是一項國內(nèi)多中心、隨機、開放、陽性對照、優(yōu)效性的Ⅲ期臨床研究。研究人群為既往接受過曲妥珠單抗(包括已上市類似物)和紫杉烷類藥物單獨或聯(lián)合治療失敗后的HER2 陽性晚期乳腺癌患者。
百奧泰表示,根據(jù)弗若斯特沙利文報告,中國HER2陽性乳腺癌的抗HER2 ADC藥物的總市場規(guī)模2020年預計約為0.17億元,未來預計將以207.4%的年復合增長率,于2024年達到14.88 億元,并在2024年至2030年間以10.4%的年復合增長率增長到26.97 億元。公司因終止該項目可能會導致公司在上述市場失去競爭地位。
逾2億研發(fā)費用打水漂
百奧泰目前的上市銷售及研發(fā)管線如何?其2020半年報顯示,截至2020年6月末,公司僅有格樂立(阿達木單抗注射液)1個產(chǎn)品獲得上市批準,有23個主要在研產(chǎn)品,其中2個產(chǎn)品已經(jīng)提交上市申請,3個產(chǎn)品處于III期臨床研究階段,2個產(chǎn)品處于II期臨床研究階段,5個產(chǎn)品處于I 期臨床研究階段。
研發(fā)費用方面,百奧泰財報顯示,2017年至2019年以及2020年前三季度,公司研發(fā)費用分別為2.37億元、5.41億元、6.37億元和4億元。
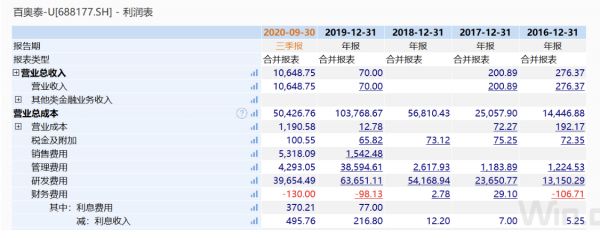
數(shù)據(jù)來源:Wind
百奧泰近期發(fā)布的2020年業(yè)績預告顯示,公司預計2020年年度歸屬于母公司所有者扣除非經(jīng)常性損益后的凈利潤虧損4.9億元至5.88億元元 , 相 比 上期減少虧損0.97億元至1.95億元。
隨著百奧泰宣布終止BAT8001針對 HER2陽性乳腺癌的臨床試驗,逾2億元的研發(fā)費用打了水漂。百奧泰2月8日晚公告表示,截至2020年12月,公司BAT8001研發(fā)項目累計投入2.26 億元。按照相關會計準則和公司會計政策,該項目的全部研發(fā)支出已計入相應會計期間損益。
多家藥企已布局抗乳腺癌ADC藥物
乳腺癌常被稱為“粉紅殺手”,其發(fā)病率位居女性惡性腫瘤的首位,也是中國女性常見的癌癥。目前乳腺癌的藥物研發(fā)以抗體類藥物為主,其HER2是抗體研發(fā)的主要靶點。化藥小分子研發(fā)則以EGFR、HER2、CDK4&6為主要靶點。
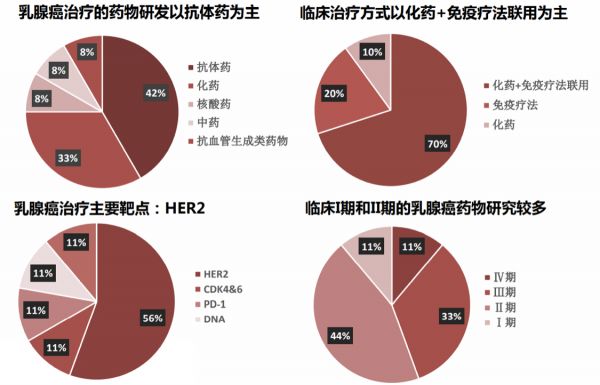
圖片來源:西南證券
根據(jù)弗若斯特沙利文報告,2015年到 2019年間,中國 HER2 陽性乳腺癌患者的數(shù)量由 8.00萬增加至8.58萬,年復合增長率為1.8%。預計到 2024 年中國HER2陽性乳腺癌患者人數(shù)將達到9.25萬,隨后患者人數(shù)將以1.0%的年復合增長率持續(xù)增長,并于2030年達到9.81萬。
近年來,隨著ADC(即抗體藥物偶聯(lián)物,由單克隆抗體、細胞毒藥物、連接體三部分構成)技術的逐漸成熟,已經(jīng)成為國內(nèi)外乳腺癌抗體藥物研發(fā)的新熱門方向。
目前已經(jīng)上市了兩款靶向HER2的ADC產(chǎn)品,為羅氏的Kadcyla和阿斯利康/第一三共的Enhertu (DS-8201),其中Kadcyla在2019年的銷售額已經(jīng)達到了15.72億美元。Kadcyla獲批的適應癥包括晚期HER2+乳腺癌的后線治療以及早期高危HER2+的術后輔助治療,而DS-8201則在除乳腺癌外的肺癌、胃癌、結直腸癌、尿路上皮癌等腫瘤類型中都展現(xiàn)出優(yōu)異療效。
而國內(nèi)藥企方面,浙江醫(yī)藥(600216.SH)、科倫藥業(yè)以及港股上市公司榮昌生物(09995.HK)均在ADC藥物針對乳腺癌方面有臨床研究。
浙江醫(yī)藥2019年12月公告表示,公司收到國家藥品監(jiān)督管理局藥品審評中心(CDE)同意開展重組人源化抗HER2單抗-AS269 偶聯(lián)注射液(代號:ARX788)II/III 期臨床試驗的回復。ARX788用于治療HER2陽性晚期乳腺癌和胃癌等。截至2019年9月30日,浙江醫(yī)藥ARX788項目已累計投入研發(fā)費用 2.09 億元。
榮昌生物2020年12月公告表示,維迪西單抗(RC48)是一款抗HER2的抗體藥物偶聯(lián)物,針對具有大量未被滿足醫(yī)療需求的常見癌癥,且是中國第一個進入臨床階段的中國內(nèi)地自主研發(fā)的ADC產(chǎn)品。榮昌生物正在中國進行針對HER2低表達的BC(乳腺癌)的注冊性臨床試驗。
除了上述提及的浙江醫(yī)藥和榮昌生物之外,科倫藥業(yè)也在研發(fā)抗乳腺癌ADC藥物。
科倫藥業(yè)于2021年1月10日接受投資者調(diào)研時表示,A166 HER2 ADC的國內(nèi)臨床研究,按照CDE的要求在2020年四季度已完成拓展乳腺癌有效劑量患者的入組。A166項目中國爬坡和首發(fā)適應癥拓展已經(jīng)完成,關鍵II期臨床開展時間,如果與監(jiān)管部門溝通順利,預計最快在今年4月份啟動,最遲Q3啟動;BLA時間,如果順利,應該是在2022年下半年。
在療效及安全性方面,科倫藥業(yè)介紹稱,A166 I期爬坡,在3.6mg觀察到有效,6.0mg也未出現(xiàn)劑量限制毒性,在劑量擴展階段,針對HER-2 陽性的乳腺癌,我們使用4.8mg和6.0mg兩個劑量擴展。一個劑量是有20幾例的數(shù)據(jù),一個劑量是有10幾例的數(shù)據(jù),從數(shù)據(jù)來看,有效性呈現(xiàn)劑量反應關系,也就是說6.0mg肯定比4.8mg更好。安全性上,6.0mg也未出現(xiàn)劑量限制性毒性。研究院內(nèi)部希望使用6.0mg作為后續(xù)關鍵II期的定量,6.0mg可能使A166成為best in class的劑量,可以和DS-8201去競爭的。準備按照這個劑量和監(jiān)管進行溝通。如果能夠獲批,肯定會用6.0mg進行申報,從而保證A166有更好的效果。如果監(jiān)管對6.0mg有疑問,4.8mg劑量下的數(shù)據(jù),也一定優(yōu)于羅氏的T-DM1。
科倫藥業(yè)同時表示,從A166數(shù)據(jù)上可以看到,我們在對HER2陽性乳腺癌末線的治療上有強烈的信心,正在和監(jiān)管部門進行積極溝通,快速推動注冊臨床,預計在Q2披露數(shù)據(jù)。A166在4.8mg和6.0mg不論是療效還是安全性都有著不輸競品的表現(xiàn),因此這兩個產(chǎn)品已經(jīng)走過了成藥的風險期和me too階段,目前希望能夠抓到best in class的機會。
中金公司認為,隨著ADC關鍵技術的進展與突破,近兩年共獲批上市了5款ADC藥物,產(chǎn)品上市節(jié)奏加快。且由于HER2ADC藥物DS-8201以及Trop-2 ADC藥物Trodelvy的優(yōu)異療效,整個ADC行業(yè)熱情高漲,重磅并購頻出,以ADC為代表的新技術將引領下一個十年的新藥研發(fā)。


京公網(wǎng)安備 11010802028547號